El equipo científico de la Universidad Pablo de Olavide dirigido por el catedrático José Antonio Sánchez Alcázar ha publicado recientemente un estudio en la revista International Journal of Molecular Sciences en el que demuestra que las mutaciones del gen WDR45 en modelos celulares BPAN provocan alteraciones en la autofagia, el metabolismo del hierro y la bioenergética celular. El tratamiento con antioxidantes mejoró parcialmente la fisiopatología celular, sin embargo, la autofagia y la bioenergética celular siguieron afectadas.
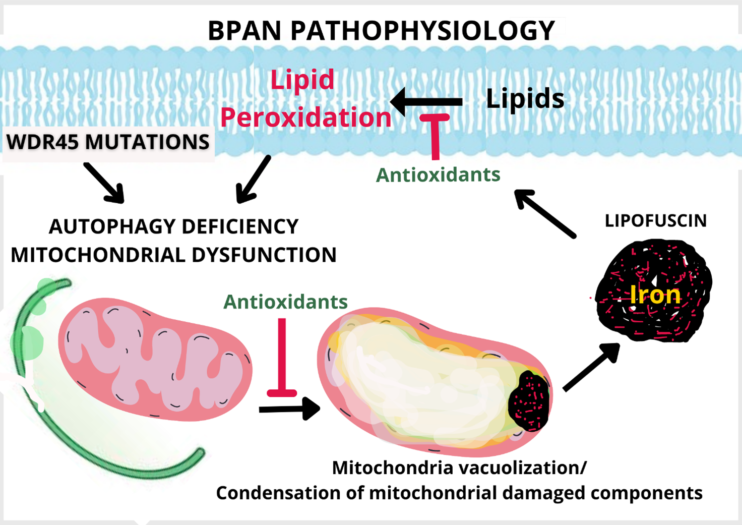
La neurodegeneración con acumulación de hierro en el cerebro (NACH) es un grupo de trastornos neurogenéticos raros frecuentemente asociados con la acumulación de hierro en los núcleos basales del cerebro. Entre los subtipos de NACH, la neurodegeneración asociada a la proteína β-propeller (BPAN) se relaciona con mutaciones en el gen de la autofagia WDR45. El objetivo de este estudio se ha centrado en demostrar los defectos autofágicos y las consecuencias patológicas secundarias como la acumulación de hierro, la peroxidación lipídica y la disfunción mitocondrial en modelos celulares derivados de dos pacientes que albergan mutaciones en WDR45.
WDR45 regula la autofagia, un mecanismo de degradación y reciclaje de componentes celulares disfuncionales. Aunque no está aún claro cómo la deficiencia en la expresión de este gen conduce a la sobrecarga de hierro cerebral, el aumento de hierro tóxico en los fibroblastos de dos pacientes afectados por BPAN sugiere que las alteraciones en la homeostasis del hierro están asociadas con la deficiencia de WDR45.
El equipo de Sánchez Alcázar analizó los niveles de expresión de WDR45 en líneas celulares de fibroblastos derivadas de dos pacientes de BPAN y dos sujetos sanos. Los niveles de expresión de WDR45 se redujeron notablemente en los primeros, mientras que los fibroblastos de control presentaban niveles normales. El análisis de microscopía electrónica de transmisión (TEM) de las células BPAN mostró vacuolización mitocondrial asociada con la acumulación de agregados que forman gránulos de lipofuscina dónde se acumula el hierro. Este proceso se explica como un mecanismo mediante el cual las mitocondrias se desprenden de sus componentes oxidados y dañados, al no poder ser eliminados por el mecanismo normal de la autofagia.
El tratamiento con antioxidantes como el pantotenato, la vitamina E y el α-lipoico impidieron la degradación oxidativa de los lípidos y la acumulación de hierro; sin embargo, los antioxidantes no lograron corregir los niveles de expresión de WDR45, el defecto de autofagia ni la bioenergética celular.
Este trabajo ha contado con la estrecha colaboración de Susana González-Granero y José Manuel García-Verdugo, de la Universidad de Valencia, y de Antonio Díaz del Institute for Aging Studies (Albert Einstein College of Medicine, Nueva York).
Proyecto BrainCure
Esta investigación se enmarca en el Proyecto BrainCure, desarrollado por el equipo científico dirigido por José Antonio Sánchez Alcázar, del Departamento de Fisiología, Anatomía y Biología Celular de la UPO. Desde que se pusiera en marcha en 2014, el equipo de BrainCure ha logrado grandes avances. Estos científicos y científicas proponen una visión ambiciosa y adaptada al nuevo concepto de medicina personalizada. Así, su trabajo se centra en evaluar la efectividad terapéutica de los distintos tratamientos en los fibroblastos derivados de los pacientes y en las células neuronales generadas por reprogramación directa.
Las evaluaciones personalizadas en modelos celulares derivados de pacientes pueden ser útiles para evaluar el comportamiento de mutaciones particulares bajo diferentes opciones terapéuticas y, por lo tanto, seleccionar los suplementos y las concentraciones de dosis más efectivos teniendo en cuenta sus propiedades farmacocinéticas. De esta manera, los resultados obtenidos en el laboratorio con modelos celulares de los propios pacientes podrán ser trasladados a la investigación clínica para la realización de ensayos clínicos controlados. Este equipo científico, que lleva a cabo sus trabajos en el CABD, está realizando actualmente medicina personalizada en más de cuarenta pacientes procedentes de España y otros países como Brasil, Colombia, México, EEUU, Francia, Reino Unido, Holanda, Hungría y Polonia.
En la actualidad el Proyecto BrainCure está realizando medicina de precisión en los 5 subtipos más frecuentes: PKAN, neurodegeneración asociada a pantotenato kinasa, con mutaciones en el gen PANK2; PLAN, neurodegeneración asociada a PLA2G6, con mutaciones en el gen PLA2G6; BPAN, neurodegeneración asociada a la proteína beta-propeller, con mutaciones en el gen WDR45; MPAN, neurodegeneración asociada a la proteína de la membrana mitocondrial, con mutaciones en el gen C19orf12; y FAHN, neurodegeneración asociada a la hidroxilasa de ácidos grasos, con mutaciones en el gen FA2H.
Referencia:
Suárez-Carrillo A, Álvarez-Córdoba M, Romero-González A, Talaverón-Rey M, Povea-Cabello S, Cilleros-Holgado P, Piñero-Pérez R, Reche-López D, Gómez-Fernández D, Romero-Domínguez JM, et al. Antioxidants Prevent Iron Accumulation and Lipid Peroxidation, but Do Not Correct Autophagy Dysfunction or Mitochondrial Bioenergetics in Cellular Models of BPAN. International Journal of Molecular Sciences. 2023; 24(19):14576.
https://doi.org/10.3390/ijms241914576